2019年回顾:FDA药物评估和研究中心批准的新药
2019年,FDA药物评估和研究中心(CDER)总共批准了48种新药。新药和生物产品的获准上市意味着可为提供患者新的治疗选择,为公众改善医疗健康带来利好消息。
以下所列为CDER在2019年批准的新分子实体(“NME”)和新的治疗用生物(多肽、单克隆抗体、融合蛋白、细菌毒素等)产品。此列表不包含生物制品评估和研究中心(CBER)批准的疫苗、过敏原产品、血液和血液产品、血浆衍生物,细胞和基因治疗产品或其它产品。
其中,所列药品有一些与先前批准的产品相同或相关,它们将与市场上的那些产品竞争。
从FDA审查角度,某些药物被归类为新分子实体:这类药品包含以前未经FDA批准的活性成分,无论是作为单一成分药物还是作为复合产品的一部分;或是通常为患者提供重要的新疗法。某些药品出于管理目的被定性为NME,但包含与FDA先前批准的产品中的活性部分密切相关的活性部分。例如trifarotene,一种类维生素A化合物(序号28)。出于FDA审查的目的,CDER将根据《公共卫生服务法》(Public Health Service Act)第351(a)条提交申请的生物产品,无论该机构先前是否已批准过其它产品中的相关活性部分,均归类为NME。这与FDA按照“联邦食品,药物和化妆品法”(Federal Food, Drug, and Cosmetic Act)确定一种药品是否为“新化学实体”(“NCE”)是不同的概念。CDER在1月6日发布这份目录时做了上述说明。
获准药品一览表(按获准时间排序)
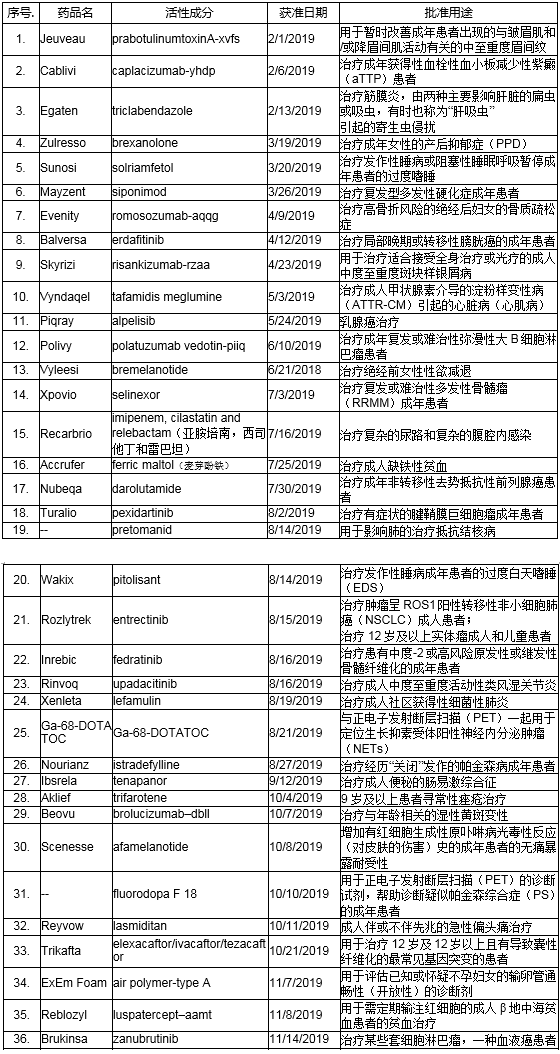
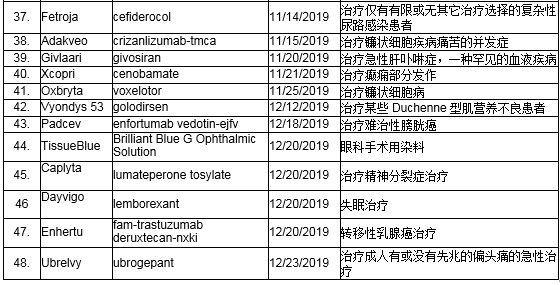
* 所列“用途”仅供参考。FDA批准每种药品的具体使用(例如适应症、适用人群,给药方案),请参阅FDA批准的处方信息或药品说明书 。
来源:医药地理



