继疫苗后 中国新冠中和抗体研究也跻身全球前沿水平
君实生物6月7日宣布,其与中国科学院微生物研究所共同开发的重组全人源抗SARS-CoV-2单克隆抗体注射液(以下简称“JS016”)获批进入I期临床试验阶段,并在复旦大学附属华山医院完成首例受试者给药。
据悉,该试验是一项随机、双盲、安慰剂对照研究,由复旦大学附属华山医院张菁教授与张文宏教授联合主持,以评价JS016静脉输注给药在中国健康志愿者中的耐受性、安全性和药代动力学特征及免疫原性,为探索JS016在人体中抗新冠病毒的治疗与预防疗效提供依据。值得一提的是,这是全球首个在健康受试者中开展的新冠病毒中和抗体临床试验,也是国内最早进入临床阶段的新冠病毒中和抗体。
以往临床试验表明单克隆中和抗体能降低埃博拉病人病毒水平,起到有效中和病毒毒力、实质性改善临床症状、降低感染者死亡率等作用。
JS016是从康复期病人体内快速筛选并在体外重组表达具有高度病毒中和能力的全人源单克隆抗体。临床前研究显示,JS016对新冠病毒刺突蛋白(S蛋白)的受体结合区域(RBD)表现出极高的特异性亲和力,达到nM水平,能够抢先与病毒结合,从而从源头阻断病毒入侵宿主细胞。
在有效性方面,恒河猴动物感染实验显示JS016表现出治疗和预防效果,相关数据在线发表于国际权威期刊《自然》杂志(Nature,IF 43.070),这是全球首个报告抗新冠病毒中和抗体的非人灵长类动物实验结果。
在安全性方面,JS016抗体基因来源于康复病人单个B细胞,是全人源天然抗体,经人体免疫系统筛选,不结合人体自身抗原,预期有较好的安全性。此外,为了减少抗体介导的急性肺损伤风险,确保临床应用中的安全性,研究团队对JS016进行了Fc区域改造,有效降低了可能存在的抗体依赖增强效应(ADE)、抗体介导的细胞毒作用(ADCC)以及细胞吞噬效应(ADCP)。临床前食蟹猴毒理学研究中,最大耐受剂量(MTD)及未观察到明显毒性反应剂量(NOAEL)是人体临床试验推荐起始剂量的数十倍,提示存在较大的安全窗,也为JS016临床试验发挥安全、稳定、有效的作用提供了可靠的科学依据。
针对新冠病毒,中和抗体药物可能是有效的应对手段之一。2020年2月至今,包括再生元、礼来、阿斯利康、Celltrion等诸多药企均在持续研发中。截至目前,全球新冠中和抗体药物共有两家公司宣布获批进入人体临床,另一家是加拿大药企AbCellera与礼来合作的LYCoV555,于6月1日进入I期临床。
而对于JS016,礼来同样“有份”。5月4日,君实生物宣布与礼来关于新冠中和抗体药物研发的合作协议,协议内容主要包括:
(1)授权礼来在大中华区以外对君实新冠抗体开展研发、生产和销售的独占许可;礼来将向公司支付1000万美元首付款,并在每一个君实新冠抗体(单用或组合)实现规定的里程碑事件后,向公司支付最高2.45 亿美元的里程碑款,外加该产品销售净额两位数百分比的销售分成。
(2)双方将推进新冠抗体新药临床试验和商业化,按照双方同意的条款和条件下,礼来将以7500万美元认购君实生物新发行的H股股份(潜在认购)。
为尽快找到新冠病毒的“解药”,全球多管齐下。疫苗方面,根据联合国卫生组织的统计,全球应对新冠病毒的候选疫苗项目达133个,中国大陆已有6个在临床试验中。抗体药物方面,根据Evaluate 网站6月4日最新统计,全球抗新冠病毒的抗体及蛋白类研发项目达18个,再生元、阿斯利康等国际巨头的此类项目都将在6月及以后陆续进入人体临床。
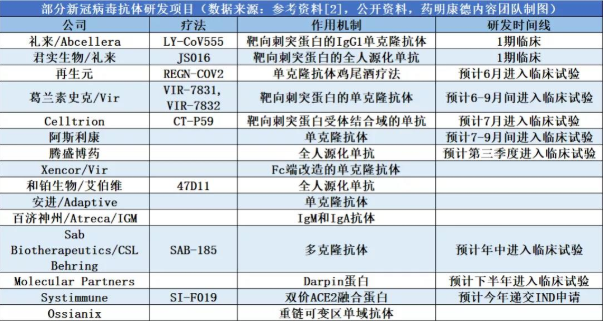
图源:药明康德
参考资料:
1、君实生物公告
2、国金证券:中国首个新冠中和抗体获批IND 完成首例注射
来源: 新浪医药新闻 2020-06-08



