透明带来信任:FDA 宣布披露用于支持紧急使用授权的审评信息
美国 FDA 于 11 月 17 日发布通告承诺公开披露用于授权、修订或撤销药品紧急使用授权(EUA)的科学数据和其它审评信息。
FDA 局长 Stephen Hahn 在一份声明中表示,“我们认识到,披露科学审评文件中支持针对包括疫苗在内的药品和生物制品的 EUA 的发布、修订或撤销的信息,将有助于公众增强对 FDA 严格审评科学数据以及合理使用授权产品的信心。”
具体来说,当 CDER 或 CBER 监管的产品被授权用于紧急使用、或已发布的 EUA 被修订或撤销时,FDA 打算在适当的范围内并在法律允许下公开 CDER 和 CBER 对支持决定的科学数据和信息的审评。FDA 表示,目标是在可行的情况下公开 EUA 审评文件中的信息,与 FDA 在新药和生物制品获得批准后发布科学审评的长期做法保持一致。FDA 补充指出,根据美国《信息自由法案》(FOIA),可能会删除某些免于披露的信息。
Hahn 在声明中坚定地表示,每个 EUA 都“基于数据和科学”,并且在紧急情况下,这些 EUA 是“独特且重要的公共卫生工具。”他还试图更清楚地解释有关每个 EUA 决定的 FDA 思维和行动,然后介绍了旨在提高透明度的其它措施,例如,计划召开咨询委员会会议来审查 COVID-19 候选疫苗。
与 FDA 宣布这一承诺的同一天,美国政府问责办公室(GAO)发布了一份报告(报告请登录识林资讯阅览),指出 FDA 未能像接受正常审评程序的药品那样,“统一披露对紧急使用授权的安全性和有效性数据的科学审评。”
此前,FDA 因为其对于新冠(COVID-19)治疗产品 EUA 的决定广受批评,导致了公众对 FDA 前所未有的信心缺乏。这些颇受争议的 EUA 决定还引发了更多关于 FDA 受到政治压力的担忧, 3 月份在美国总统特朗普大力吹捧羟氯喹后,FDA 发布了使用氯喹和羟氯喹治疗 COVID-19 疾病的 EUA,但没有提供支持其决定的有限证据的细节,而在三个月后 FDA 撤销了该 EUA。
COVID-19治疗产品紧急使用授权时间表
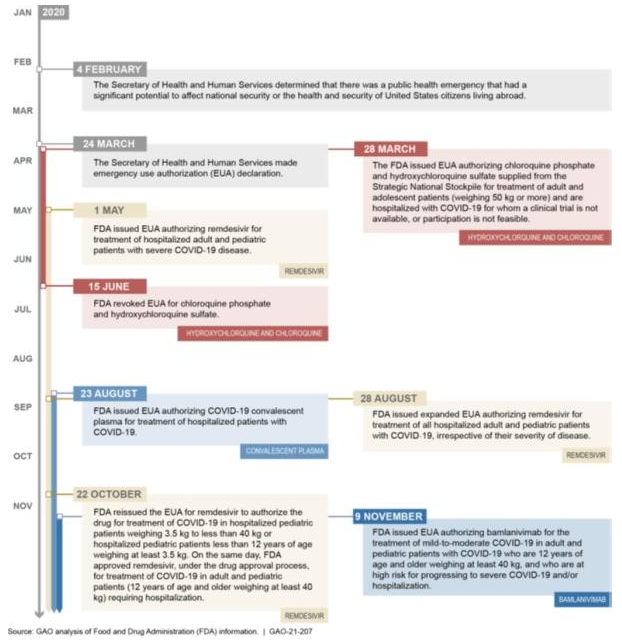
(截至2020年11月9日)
美国达特茅斯学院政府学系研究药物监管政策的 Herschel Nachlis 之前曾专门撰文,提出 FDA 在 EUA 决策中提高透明度,对于在激烈政治环境中做出科学决策、增强独立性和严格性的重要性。
约翰霍普金斯大学公共卫生学院卫生政策与管理系教授,曾任 FDA 首席副局长的 Joshua Sharfstein 对 FDA 这一举措表示欢迎,他曾批评 FDA 未能更全面地推进透明度计划,并且未能解释更快、更彻底地批准或不批准一个产品的各种决定。
他表示,“这是 FDA 向透明化迈出的重要一步。公众和临床界不仅应该了解 FDA 已做出的决定,还应该了解做出决定的原因。在这个充满挑战的时候 , FDA 的透明度对于其自身信誉和公众信任至关重要。FDA 今天的承诺是朝着这个方向迈出的一步,比任何其它事情都重要。我们必须看看具体操作情况,但我确实认为这是正确的原则。”
借用 FDA 前任局长 Scott Gottlieb 的一句话 , "You earn public confidence in small drops and you lose it in buckets。赢得公众信任靠一点一滴,但失去时可以是一罐一桶”。FDA 今日的措施只是第一步 , 想要重塑已经遭到破坏的公众信任,还需未来脚踏实地在每时每事上独立、公开、公正的表现。
作者:识林-Aspen
来源:新浪医药



