医药研发政策环境40年蝶变
美国能成为全球最顶尖的制药帝国,跟其背后强大的药品监管机构——美国食品药品监督管理局(简称 FDA) 有着密不可分的关系。FDA在药品研发、注册、监管、流通等领域政策法规导向的合理和先进性,对我国药品监管来说具有巨大的借鉴意义。
我国药品监管上遗留了很多历史问题,也经历了多次改革。回顾每一次改革,多数以旧问题被积压,新问题又出现告终,改革并不深入和彻底。从2015年8月18日国务院发布关《改革药品医疗器械审评审批制度的意见》起,我国对药品医疗器械审评审批制度再次进行了大刀阔斧地改革。
创新药的政策改革之路
我国对“新药”的定义经历了多次变更,“新药”的定义从 1985 年“我国未生产过的药品",到 2002 年“未曾在中国境内上市销售的药品”,再到 2015 年才终于确定为“未在中国境内外上市销售的药品”,新药从“中国新”到“全球新”的转变,整整摸索了30年。
药品上市许可持有人制度的建立是我国药品监管走向国际化的一项大改革。MAH 出台之前,我国实行的是上市许可和生产许可统一捆绑的管理模式,MAH 实施后,药品研发和药品生产实现分离,药品研发机构和科研人员也拥有药品的批准文号,使我国药品研发格局发生了变化。
临床试验机构资格认定实行备案管理。具备临床试验条件的机构在食品药品监管部门指定网站登记备案后,可接受药品医疗器械注册申请人委托开展临床试验。优化临床试验审批程序,临床试验申请默示许可制。在境外多中心取得的临床试验数据,符合中国药品医疗器械注册相关要求的,可用于在中国申报报注册申请。为实现国内国外药品同步上市迈出了积极的一步。
仿制药研发环境创新之路
“仿制药”是与被仿制药具有相同的活性成分、剂型、给药途径和治疗作用的替代药品,具有降低医疗支出,提高药品可及性,提升医疗服务水平等重要经济和社会效益。
改革开放以来,我国仿制药行业取得了快速发展,为保障广大人民群众的身体健康作出了重大贡献。但也要看到,我国仿制药行业大而不强,“多小散乱差”的局面仍还存在,药品质量差异较大,高质量药品市场主要被国外原研药占领,部分原研药价格虚高,广大人民群众对高质量仿制药的需求与现行药品可及性和可负担性相比,还有一定差距,迫切需要改革完善。
2013 年,国家食品药品监督管理总局就提出了开展仿制药质量和疗效一致性评价工作。2015年,原国家食品药品监督管理总局发布《关于化学药生物等效性试验实行备案管理的公告》, 2016年,国务院发布《国务院办公厅关千开展仿制药质蜇和疗效致性评价的意见》,一致性评价工作才算落实实施。
《中国上市目录集》,它有一个更为业界熟知的名字:《中国橙皮书》。它对于我国药品研发具有同等意义,其收录了中国具有安全性、有效性和质量可控性的药品,并确定了参比制剂和标准制剂,进行实时更新。在建立《中国上市目录集》的基础上,制定鼓励仿制的药品目录,让更多制药企业通过公开竟争方式获得仿制研发权益。
2017 年,原国家食品药品监督管理局总局(CFDA) 正式成为国际人用药品注册技术协调会(ICH) 成员,意味着中国在药品研发和注册国际化道路上迈出了历史性一步。另外,发布的《关于调整原料药、药用辅料和药包材审评审批事项的公告》实行药品与药用原辅料和包装材料关联审批。原料药的关联审评制度的实施终止了原料药批准文号制度,也被视为 DMF( 药物管理档案)制度的过渡期政策。
回顾40年药品保护
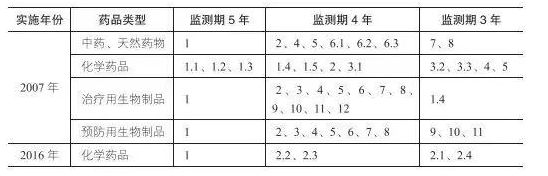
2002 年颁布的《药品注册管理办法》(试行)中提出了“新药监测期”的概念,监测期内的新药,国家药品监督管理局不批准其他企业生产和进口。新药监测期只针对国产药品,对于进口药品不予监测。2016 年化药注册分类改革,将国产新药划分为创新药和改良型新药,均可设立不同年限的监测期(包括增加新适应症的情况),鼓励新药研发(见下表)。
专利制度在药品研发中有着很重要的地位,我国第一部《专利法》在1984年3月21日颁布,1993年实施的《专利法》中将药品和用化学方法获得的物质从不授予专利权项下剔除,2017年10月国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见,针对药品知识产权的保护也提出了相应的要求。
我国政府高度重视对中药品种的保护,实行中药品种保护制度 1991 年国务院把中药品种的保护法规列入国家立法计划,1992年10 月14 日国务院颁布《中药品种保护条例》。
原国家食品药品监督管理局在《中药品种保护条例》的基础上又颁布了《中药品种保护指导原则》,对原条例在具体操作细节上进一步规范。同时,国家为了振兴传统中医药而制定的《中医药法》,在2016年底通过。作为中药保护法律体系的上位法,明确了中医药在我国医药体系中的重要位置,为中医药发展的各个方面提供了法律支撑。
研发环境沧桑巨变
如下图所示,近5年来,我国创新药研发有了很大程度的提升。尤其是2017年,国内化药、生物药的创新药申报出现了大幅度的增加, 2017 年申报的生物创新药相比 2016 年涨幅达到了 126.7% 。
2013-2017年创新药的申报情况(品种计)
国外制药发达国家的新药研发主体是企业,大学、科研机构主要着重基础研究。同样地,我国基础研究力量也主要集中在科研院所,如北大药学院、中国药科大学、沈阳药科大学、中国科学院上海药物研究所新药研究国家重点实验室等。目前也有相当部分创新型企业通过和国内科研院所或国外研究机构合作的方式进行新药的开发,或者企业自主进行研发,我国新药研发的途经和方式在逐渐的多样化,但是都不能离开基础研究。
2017年国家人力资源和社会保障部公布了最新的医保目录,距离上一次国家医保目录的更新已经8年之久。而本次调整将包括西达本胺、埃克替尼、康柏西普等在内的多个国产创新药全部纳入。随着一致性评价工作的展开,我国各省市对通过一致性评价的药品,陆续出台了在药品采购方面的政策支持, 有利于促进与原研药质量和疗效一致的仿制药和原研药平等竞争。重大新药创制科技重大专项于 2008 年启动实施。重大新药创制科技重大专项是当前鼓励创新药物研制的诸多措施之一。
另外,药品的技术转让的政策环境经历了“限制转让—鼓励转让—限制转让—MAH制度落地”的变化过程。
来源:药智网



