FDA发布医疗器械一级召回通知 涉飞利浦、雅培、美敦力
本周,美国FDA发布了三项医疗器械I类召回通知,涉及产品分别来自雅培、飞利浦医疗和美敦力。I类召回无论在中国还是美国都是最严重的召回类型,其意味着使用这些医疗设备可能会导致严重的人身伤害甚至死亡。
.png)
来自FDA官网
11月4日,FDA通知召回全美381台雅培生产的CentriMag急性循环支持系统(批号:L05333-0001-L06608-0024),发行日期为2017年11月22日至2019年8月6日。
CentriMag系统用于在心脏手术期间将血液泵送至患者体内,可维持长达6个小时;并且还能为心源性休克的患者提供长达30天的临时血液循环支持,即当患者心脏的右侧失去泵动力,血液回流到身体的静脉中时(急性右心衰竭),该患者最多可使用30天。该系统包括一个调控泵速度和流量的控制台,以及将控制台连接到电动机的电缆,从而可以灵活地选择泵的电动机和泵的位置。
召回原因主要是由于电磁干扰导致该设备的校准系统错误,该错误可能致使泵减速或停止,控制台屏幕变为空白以及各种不准确的警报。如果泵速度变慢或停止,则可能会给患者带来不利后果,例如中风、严重的器官损害甚至死亡。雅培方面已于2019年8月发起召回,当时已报告44人受伤,1人死亡。此产品尚未在国内上市。
同一日,FDA还通知召回全美852台飞利浦医疗的Forte Gamma摄像系统,涉及产品包括:
· Forte (882020)
· Forte Jetstream (882290)
· Forte Jetstream upgrade (882291)
· Forte Jetstream AZ (882320)
· Forte Jetstream AZ upgrade (882321)
· Diamond Select Forte (889456)
· Diamond Select Forte JETStream (889471)
生产和制造日期为1998年1月1日至2008年12月31日。
据悉,医疗机构使用飞利浦医疗Forte Gamma摄像头系统查看患者体内结构或功能的图像,以进行诊断、设计治疗方案和评估疾病。在测试之前,患者会接受造影剂,该造影剂将用作成像检查的一部分。
.jpg)
Forte Gamma摄像头系统的召回原因是该检测器(重量为660磅)有可能在没有任何警告的情况下与设备分离,从而可能导致严重的伤害,例如压伤、困住患者或导致死亡。飞利浦医疗此前收到一则客户投诉,至今没有严重受伤或死亡的报道。该公司方面已于今年9月发起召回,目前已经停止使用Forte Gamma相机系统,直到对系统进行更正。
11月5日,美国FDA又更新一则召回通知,针对美敦力生产的MiniMed 500型遥控器和503型远程变送器(MMT-500和MMT-503),全美召回1117台,设备发行日期为1999年8月6日至2018年7月24日。
据了解,召回的设备属于MiniMed胰岛素泵的一部分,该泵包括一个遥控器,设计为与泵无线通信,以向糖尿病患者输送特定量的胰岛素。
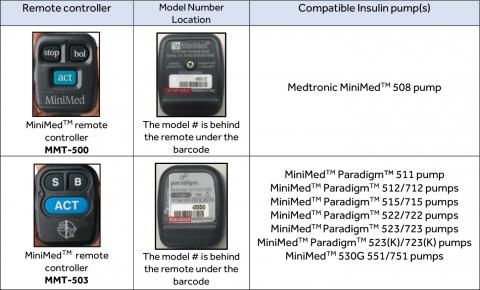
美敦力召回的MiniMed胰岛素泵
由于潜在的网络安全风险,未经授权的人(涉及除患者、护理人员或医疗保健提供者以外的其他人)可能会记录并重置遥控器与MiniMed胰岛素泵之间的无线通信。据报道,其他人可指示胰岛素泵将胰岛素过度输送给患者,从而导致患者出现低血糖,或者停止胰岛素输送致患者发生高血糖、糖尿病性酮症酸中毒,甚至死亡。
美敦力方面从2018年8月开始召回指定的胰岛素泵,今年6月再次发布安全警报,提示黑客有可能访问和改变其胰岛素泵设备。迄今为止,FDA尚未发现任何与这些潜在的网络安全风险相关的患者伤害报告。此次涉及产品部分已在国内上市,美敦力中国此前已提示国内关注MiniMed™ 508以及MiniMed™ Paradigm™ 712、712E、722胰岛素泵。
来源:新浪医药



